Roberto
sabato 27 giugno 2020
Curricula
mercoledì 30 gennaio 2019
Depirogenizzazione vetreria
DEPIROGENIZZAZIONE
Come indicateribiologici del processo di Depiroenizzazione
Validazione LAL-Test

- LIMULUS POLIPHEMUS
- LIMULUS POLIPHEMUS (Lineo, 1758)
- Esemplare di limulus donato nel 1817 dal bolognese Gandolfi a mons. Camillo Razzani (1775-1841),direttore del Museo di Stotia Naturale di Bologna dal 1803 al 1841.
- Le osservazioni che Ranzani effettuò , sulla morfologia di questo animale furono utilizzate dal naturalista per cercare di confutare le nuove teorie trasformiste ed evuluzionistiche proposte all’epoca, da Lamarck
- Il Limulus Poliphemus è un artropode rimasto invariato dal triassico inferiore , vale a dire da 225 milioni di anni fa ad oggi .
- E’ l’ultimo parente vivente della Classe dei Trilobiti, organismi diffusissimi nei mari paleozolici.
- I Trilobiti , estinti dal Permiano ( un’estinsione di massa che avvenne circa 251,4 milioni di anni fà ) , facendo da limite tra il periodo geologico Permiano e il periodo Triassico.
- VALIDAZIONE
- La validazione è la prova sicura e documentata che un determinato processo produrra’ in modo continuo e con la qualità specificata , i risultati attesi .
VALIDAZIONE
– Istruzioni del produttore dei reattivi
– SOPs riferite a :
USP-BET
FDA LAL Test Guideline
GMP , 21 CFR 211
Biologics , 21 CFR 610
Si devono includere : dati di valutazione
a) Validazione LAL
b) Validazione del personale
c) Validazione del prodotto
— Standardizzazione RSE/CSE
VALIDAZIONE
La validazione è la prova sicura e documentata che un determinato processo produrra’ in modo continuo e con la qualità specificata , i risultati attesi .
Questo significa che si deve essere in grado di dimostrare e documentare che il sistema , o metodo farà nelle nostre mani cio’ che il produttore afferma .
Quando validare il Lisato ( validazione LAL)
– Ogni qual volta viene cambiato lotto del LAL o della CSE
– Ogni qual volta vengono apportate delle modifiche alle condizioni del Test
– Nel momento dell’introduzione del LAL-Test in un laboratorio
Devono essere preparate , a partire da una soluzione madre di RSE una serie di diluizioni le cui concentrazioni sono :
-2 Lambda , lambda , 1/2 Lambda , 1/4 Lambda
Devono essere eseguite 4 repliche per ciascun livello di diluizione ed alle prove devono essere aggiunti due contrlli negativi ( acqua per LAL )
Se la sensibilità trovata risulta essere compresa entro 2 Lambda e 1/2 Lambda della sensibilità ( Lambda ) dichiarata , la sensibilità è CONFERMATA e viene considerata sempre la sensibilita’ trovata e non quella dichiarata dal fornitore .
Validazione del personale di laboratorio
Allo scopo di escludere l’interferenza di eventuali fattori esterni di variabilità , legati alla manualità dell’operatore e all’idoneità del materiale usato , ciascun analista addetto all’esecuzione del LAL-Test deve ricostituire una soluzione di lisato secondo le indicazioni del fornitore e una soluzione madre di CSE ( caratterizzata in precedenza con RSE ) in acqua per LAL .
Dalla soluzione madre di CSE devono essere preparate una serie di diluizioni scalari con un fattore di diluizione 1:2 in modo tale che una delle concentrazioni di endotossina sia corrispondente al valore di sensibilità del lisato( Lambda ) e che una delle ultime diluizioni reagendo con il lisato , dia sicuramente esito negativo ( – ).
| CSE in acqua per LAL | |||||
| REPLICHE | 2 lambda | 1 lambda | 0,5 lambda | 0,25 lambda | CN * |
| 1 | + | + | – | – | – |
| 2 | + | + | – | – | – |
| 3 | + | + | – | – | n.e. |
| 4 | + | + | – | – | n.e. |
LAL Gel Clot Risultati , conferma della sensibilità del lisato
Sensibilità del lisato dichiarata dal fornitore = 0,125 EU/ml
Range di accettabilità da 0,25 EU/ml a 0,06 EU/ml
Media geometrica = Antilogaritmo di 4 X Log ( 0,125 ) / 4 = 0,125 EU/ml
* Acqua per LAL
n.e. = non eseguito
La sensibilità del Lisato è confermata !
I valori di concentrazione cirrispondenti alle ultime quattro risposte positive vengono convertiti in Log e D.S. dei valori ottenuti deve risultare non superiore a 0,365.
In caso contrario , il saggio deve essere ripetuto con otto repliche per ciascun livello di diluizione e la nuova D.S. , basata sulle ultime otto risposte positive , deve risultare non superiore a 0,306 ; Cmq in entrambi i casi la sensibilità calcolata deve essere compresa tra 2 lambda e 0,5 lambda .
Convalida di un prodotto
Allo scopo di individuare la concentrazione di un prodotto non interferente , deve essere allestita una prova di confronto facendo reagire la CSE con il lisato in presenza e in assenza del prodotto da esaminare .
La concentrazione sarà quella che risulta non interferente nelle prove preliminari ( vedi prove preliminari )
Devono essere pertanto preparate a partire da una soluzione madre di CSE una serie di diluizioni e da ciascuna di queste diluizioni si preleva 1 ml e si aggiunge 1 ml di prodotto in modo da ottenere delle soluzioni le cui rispettive concentrazioni finale sono :
– 0,12 EU + prodotto (concentr. non interf.) / ml
– 0,06 EU + prodotto (concentr. non interf.) / ml
– 0,03 EU + prodotto (concentr. non interf.) / ml
– 0,015 EU + prodotto (concentr. non interf.) / ml
Si ripete l’operazione utilizzando 1 ml della soluzione di Endotossina ( CSE ) e 1 ml di acqua per LAL al posto del prodotto , al fine di ottenere il riferimentoper la prova d’interferenza .
Devono essere eseguite quattro repliche per ciascun livello di diluizione ed alla prova devono essere aggiunti due controlli negativi : acqua per LAL e la soluzione campione alla concentrazione di saggio (non interferente) allestendo rispettivamente due e quattro repliche .
Calcolo :
I valori di concentrazione di CSE corrispondenti alle ultime 4 risposte positive di entrambe le serie ( lisato + prodotto) e (lisato in acqua per LAL)che la contengono , vengono convertiti in Log e di essi vengono calcolate le due Medie geometriche .
Gli antilogaritmi di queste Medie rappresentano due valori di sensibilità , la presenza di interferenza risulta assente se il valore relativo alla prova contenente la sostanza da esaminare con l’aggiunta di CSE risulta non superiore al doppio o non inferiore alla metà del valore riferito alla soluzione di CSE in acqua .
…..seguirà standardizzazione RSE/CSE …. continua
RSE/CSE
STANDARDIZZAZIONE
VERIFICA SENSIBILITA LISATO
La verifica della sensibilita’ del lisato ,va controllata sempre utilizzando RSE (Endotossina di riferimento)
REATTIVI :
– lisato ( LAL)
sensibilita’ dichiarata 0,06 UE/ml
–Endotossina Di Riferimento RSE (USP)
titolo 10.000 EU/flacone
MATERIALE D’USO :
-provette di vetro
-puntali apirogeni
-cronometro
MODO DI OPERARE
– lisato
1 flacone a 5,2 ml acqua per LAL ( secondo indicazione delfornitore)
– RSE ( endotossina di riferimento ) titolo 10.000 EU/ml
1 flacone a 5 ml acqua per LAL = 2000 EU/ml
1 ml a 10 ml acqua per LAL = 200EU/ml
1 ml a 10 ml acqua per LAL = 20 EU/ml
1 ml a 10 ml acqua per LAL = 2 EU/ml
1 ml a 8.33 ml acqua per LAL = 0.24 EU/ml
1 ml a 2 ml acqua per LAL = 0.12 EU/ml
1 ml a 2 ml acqua per LAL = 0.06 EU/ml
1 ml a 2 ml acqua per LAL = 0,03 EU/ml
Grazie Limulus
Parmenide, un medico greco del tempo, dichiarava : “Se solo avessi la possibilita’ di provocare artificialmente la febbre sarei capace di curare tutte le malattie.”
Questo concetto rimase immutato per molti secoli
prime indicazioni
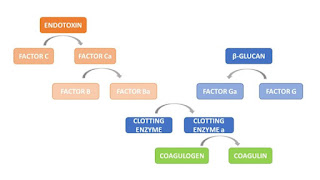
Il Limulus Amebocyte Lysate ( LAL) , se impiegato seguendo le linee guida della Food and Drug Administration USA (1) puo’ sostituire il test del coniglio per pirogeni riportato nella Pharmacopea USA sui prodotti finiti ( iniettabili nell’uomo e presidi medico-chirurgici )
Il LAL Test e’ raccomandato per la determinazione quantitativa di endotossine in materie impiegate nella produzione acqua inclusa , e per monitoraggio ” in-process ” dei livelli di endotossina . Il USP Bacterial Endotoxin Test (2) e’ il test ufficiale risposta nelle specifiche monografie della USP.
METODI LAL attualmente riconosciuti
– Gel-Clot
-GelClot Semi-Quantitativo
-Cinetico Turbidimetrico
-Cinetico Cromogenico
-Cromogenico end-point
-Turbidimetrico end-point
Bibliografie
1. Guideline on Validation of the Limulus Amebocite Lysate test as an End-Product Test for Human Parenteral Drug ,Biological Product , and Medical Devices. U.S. Department of Health and Human Service , Food and Drug Administration , December 1987
2. Bacterial Endotoxins Test , p. 1696 United States Pharmacopeia , 23 nd Revicion 1995 , U.S.Farmcopeial Convention , INC-Rokville, MD.